Dalam kimia, ada beberapa reaksi yang berjalan cepat ada pula yang berlangsung lama. Coba kita bandingkan antara reaksi perkaratan dengan reaksi pembakaran bensin. Untuk dapat mengamati perubahan dalam reaksi perkaratan kita butuh waktu beberapa hari untuk dapat melihat perubahan yang berarti. Namun untuk pembakaran bensin, ketika kita sulut dengan api, maka dalam waktu sepersekian detik, maka bensin sudah mulai terbakar (bereaksi dengan oksigen) dengan sangat cepat dan menghasilkan panas yang besar.
Dari situ kita dapat menyimpulkan bahwa sama seperti kendaraan di jalanan, reaksi kimia ada yang berjalan dengan cepat, ada yang berjalan dengan lambat. Namun bedanya, jikalau laju kendaraan diukur dengan satuan jarak per satuan waktu (misalkan meter per detik), laju reaksi kimia diukur dengan satuan molaritas per satuan waktu. Satuan waktu yang biasa digunakan adalah detik, namun tidak jarang juga digunakan satuan waktu jam, hari, bahkan tahun. Data laju reaksi kimia hanya dapat kita peroleh dari hasil percobaan.
Mari kita amati reaksi antara hidrogen dan oksigen membentuk air (H2O)
.
O2(g) + 2H2(g) à 2H2O(l)
Laju reaksi (r) dapat kita notasikan dengan beberapa cara:
aA + bB à cC + dD
Untuk lebih memahami lebih dalam, mari simak contoh soal berikut
Faktor-faktor yang mempengaruhi laju reaksi
1. Suhu
Jika dilihat dari segi mikroskopis, reaksi terjadi apabila ada dua molekul yang saling bertumbukan satu sama lain, diikuti oleh molekul-molekul lainnya. Tumbukan ini terjadi sebagai hasil dari energi kinetis (energi gerak) yang dikandung oleh setiap molekul. Namun, tidak setiap saat molekul bertumbukan akan terjadi reaksi, melainkan harus ketika jumlah energi kinetis minimum tertentu tercapai. Total energi kinetis minimum inilah yang disebut energi aktivasi. Jadi jikalau kita mencampurkan senyawa A dan senyawa B saat energi kinetisnya di bawah energi aktivasi, maka kita tidak akan melihat reaksi yanng terjadi secara makroskopis.
Lalu bagaimana caranya meningkatkan energi kinetis suatu molekul? Jawabannya adalah dengan meningkatkan suhu sistem. Misalkan kita punya senyawa A yang terdiri dari 100 molekul A dan senyawa B yang terdiri dari 100 molekul B. Pada suhu 70°C ada 50 molekul A dan 50 molekul B yang memiliki energi kinetis cukup untuk bisa bertumbukan dan bereaksi. Ketika kita naikan suhu sistem menjadi 90°C, maka jumlah molekul A dan molekul B yang memiliki energi kinetis minimum untuk bertumbukan dan bereaksi menjadi masing-masing 70 (70%). Dengan begitu, kita mempercepat laju reaksi antara senyawa A dan B.
 |
Grafik Distribusi Energi Kinetis pada Dua Suhu
Berbeda, T1 dan T2
Sumber: Chemistry, Brady et. al., hal. 666 |
Tidak cuma bergantung pada energi aktivasi, laju reaksi juga bergantung pada orientasi tumbukan. Jika orientasi tumbukan tidak tepat, walaupun molekulnya memiliki energi kinetis cukup, maka tidak akan terjadi reaksi di antara keduanya. Tetapi, jika semakin banyak molekul yang bertumbukan (diakibatkan energi kinetis terkandung dalam molekul), maka semakin besar pula kemungkinan untuk molekul bertumbukan dengan orientasi yang tepat.
 |
(a)
Orientasi Molekul yang
Efektif Mendukung Terjadinya Tumbukan
(b) Orientasi Molekul Tidak Efektif, Sehingga Tidak Menghasilkan Produk Sumber: Chemistry, Raymond Chang hal. 587 |
2. Konsentrasi
Menurut teori tumbukan, maka semakin banyak konsentrasi (semakin banyak molekul per satuan volume), maka akan semakin banyak kemungkinan molekul-molekul bertumbukan dan menghasilkan produk.
Kita ibaratkan dengan kerumunan orang di suatu tempat. Misalkan jika ada 10 orang di dalam suatu rumah yang besar, maka orang-orang di dalam rumah itu mungkin akan jarang berpapasan dan tidak akan terjadi komunikasi (membentuk ikatan). Namun jika ada 50 orang yang dijejal dalam rumah tersebut, pasti akan sering terjadi orang-orang tersebut berpapasan dan bahkan mulai membentuk ikatan (persahabatan) satu sama lain.
3. Tekanan
Tekanan berbanding terbalik dengan volume. Misalkan ketika kalian menekan piston pada sebuah tabung yang terisi udara, maka kalian berarti memperkecil volume. Dengan ini, kalian berarti memperbesar tekanan pada tabung tersebut. Ini ditandai dengan semakin sulitnya kalian menekan piston tersebut.
Dengan volume yang semakin kecil (karena tekanan semakin besar), maka konsentrasi reaktan pada suatu sistem akan semakin besar (konsentrasi atau molaritas = jumlah mol reaktan / volume reaktan). Sehingga, dengan memperbesar tekanan, maka kalian juga meningkatkan laju reaksi seperti yang sudah dijelaskan pada poin 2.
4. Luas Permukaan
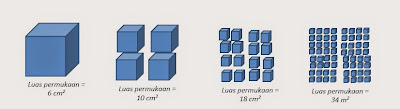
Semakin besar luas permukaan zat reaktan, semakin besar pula laju reaksi yang terjadi. Memperluas permukaan bisa dilakukan dengan cari menghaluskan bongkahan material padat. Misalkan kita punya 1 bongkah gula batu yang berukuran 1 cm x 1 cm x 1 cm, maka luas permukaannya adalah 6 cm2. Lalu bongkahan tersebut kita pecah menjadi 4 persegi panjang sama besar dengan ukuran 0,5 cm x 1 cm x 0,5 cm, maka sekarang luas permukaan total menjadi 4 x [(0,5x0,5x2) + (0,5x1x4)] = 10 cm2. Kemudian dipotong lagi menjadi 16 persegi panjang dengan ukuran 0,25 cm x 1 cm x 0,25 cm, maka sekarang luas permukaannya menjadi 16 x [(0,25x0,25x2) + (0,25x1x4)] = 18 cm2. Begitu seterusnya, semakin halus butirannya, semakin besar luas permukaannya.
Misalkan, akan lebih mudah melarutkan gula berbentuk serbuk daripada berbentuk bongkahan. Itu karena dalam bentuk serbuk, akan lebih banyak molekul gula yang bersetuhan dengan air dalam suatu waktu dibandingkan jika gula dalam bentuk bongkahan.



No comments:
Post a Comment